Как быстро открыть аптеку в Москве?
Как быстро открыть аптеку в Москве? https://real-alliance.ru/wp-content/uploads/2020/06/f236641a182f3f1655989d8d7532ea26.jpg 1920 1280 Медицинская лицензия Медицинская лицензия https://real-alliance.ru/wp-content/uploads/2020/06/f236641a182f3f1655989d8d7532ea26.jpg
В связи с этим в практически каждой аптеке собирается огромное количество людей, с целью приобрести хотя бы минимальные средства от вируса.
Исходя из этого многие мелкие, предприниматели обдумывают план, как запустить новый бизнес, который будет заключаться в открытии аптеки. Но не все так просто как кажется прежде всего стоит знать то, что прибыль от деятельности аптек приходит далеко не сразу. И сам процесс раскрутки такого бизнеса имеет определенные моменты.
Виды аптек
Аптека является основным пунктом продажи фармацевтических препаратов, но несмотря на это она имеет разделение на определенные категории. Приказ Минздравсоцразвития России от 27 июля 2010 года № 553н поможет разобраться начинающему бизнесмену какой вид аптеки стоит открыть.
В настоявшее время в России работают следующие виды аптек:
- Аптеки реализующие готовые лекарства. Данный вид аптек не подразумевает за собой изготовление лекарственных препаратов.
- Небольшой аптечный ларек или киоск.
- Вид аптек, располагающих возможностью создавать лекарства, кроме асептических препаратов.
- Индивидуальный аптечный пункт.
- Аптека производственного типа с разрешением на изготовление асептических препаратов.
Аптечный пункт
Как правило, индивидуальный аптечный пункт может быть установлен исключительно в больницах и профилактических заведениях. В силу этого данный пункт не может продавать оборудование для реабилитации, психотропные и наркотические вещества, всевозможные ядовитые препараты и лекарства, которые оказывают сильное действие на человека.
Аптечный киоск или ларек
Ларьки или киоски, как правило, отличаются от аптечных пунктов конструктивной сборкой и размещением, для создания пункта продаж лекарств необходимо соблюдать требования к тому заданию в котором он будет размещен. То, что касается продажи лекарств киоск имеет аналогичные возможности, как и аптечный пункт.
Виды налогов
В настоящее время возможность открыть даже самый обычный аптечный ларек может как предприниматель, так и юридическое лицо, но главным различием среди всех аптечных пунктов является выбор налогообложения.
Сейчас в Москве и других городах России действует довольно широкий список данных систем, например: лицензия на аптеку Москвы, патенты и ОСНО. Такой вид налогообложения как патент разрешает торговать медикаментами исключительно предпринимателям, другие последующие системы налога дают право торговать медикаментами как предпринимателям, так и юридическим лицам.
Очень важно стоит обратить внимание на то, что в любом случае данный вид заработка будет иметь свои ограничения по закону, которые включают в себя:
- размер магазина, в котором будет располагаться аптека,
- общий доход.

Более подробную информацию можно найти в Налоговом Кодексе России.
Валютная система
Последнее время практически каждый предприниматель старается реализовать свою продукцию по безналичному расчету. Именно такой вид реализации может быть допущен исключительно по упрощенной системе налогообложения или ОСНО.
Основные согласования для открытия аптеки
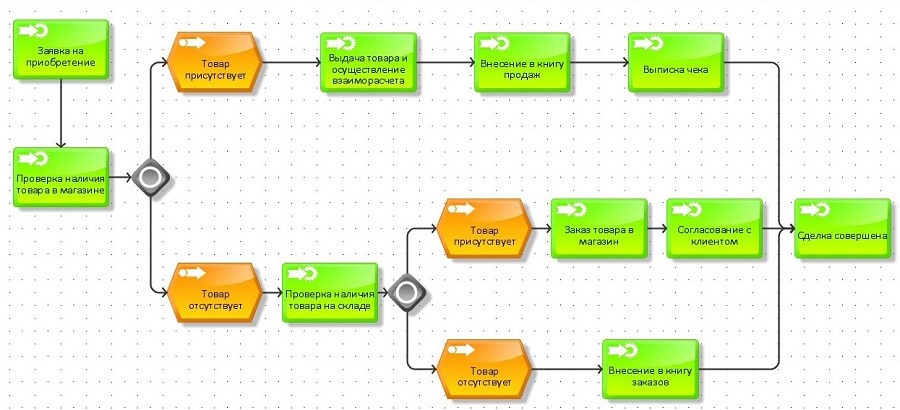
Прежде всего стоит сказать, что каждому предпринимателю, который изъявит желание открыть аптеку должен соблюдать некие согласования с государственными инстанциями. Для этого необходимо:
- найти здание или помещения;
- найти персонал работников,
- приобрести оборудование,
- иметь документальное разрешение(лицензию) на открытие аптеки полученное в государственных органах.
Инстанции, которые выдают лицензии
Среди многих государственных структур существуют структуры, которые сотрудничают с любыми предпринимателями и выдают им документальное соглашение на открытие аптеки:
- Служба МЧС.
 Данная инфраструктура выдает соответствующие разрешения на основании противопожарной безопасности объекта.
Данная инфраструктура выдает соответствующие разрешения на основании противопожарной безопасности объекта. - Роспотребнадзор снабжает всех предпринимателей санитарными книгами и паспортами на помещение или здание аптеки.
- Местные органы Росздравнадзора выдают соответствующие лицензии на открытие аптечного пункта.
Документы для открытия аптечного пункта
Как показывает практика многих предпринимателей, большее количество документации необходимо получить у местных властей. К основным документам относятся:
- Нотариально заверенные документы предприниматели или юридического лица.
- Документ разрешающий использовать помещение под аптеку.
- Соответствующая документация фармакологического образования директоров и сотрудников аптеки.
- Иметь соответствующий план и схему на него, с точным распределением коммуникаций, комнат и дверей.
Список материалов и оборудования
Но, помимо этого, каждому предпринимателю стоит индивидуально решить вопрос с местными органами власти, какие документы необходимы для открытия аптеки в определенном населенном пункте или районе города.
Выбор помещения для аптеки
Когда вопрос решен с документальным оформлением предпринимателю необходимо определиться со зданием или сооружением, в котором будет располагаться аптечный пункт. Если аптека будет находиться в магазине, больнице или ТЦ, то общая площадь территории торговли должна составлять не менее 29 м2.
Несмотря на это, учитывая расположение данного объекта, прибыль будет постоянной и наличие посетителей обеспечено, так как в магазине или ТЦ всегда есть посетители. Если речь идет об открытии аптеки в центре густонаселенного города, то тут речь идет от 43 до 75 м2.
Аренда данного помещения так будет иметь приличную сумму. Для выбора здания под аптеку каждому предпринимателю следует внимательно изучать все документальные подтверждения в связи с законодательством РФ.
Обращать внимание на два входа в помещение, заранее должен быть предусмотрен заезд для машин и автостоянку, на окнах должны располагаться решетки.
как открыть собственную аптеку.
 Развитие аптечной сети как бизнес. Сколько стоит открыть аптеку
Развитие аптечной сети как бизнес. Сколько стоит открыть аптекуВ статье мы подробно рассмотрим вопрос, как организовать аптечный бизнес. Первым шагом является регистрация компании. Это можно сделать двумя способами:
- как частный предприниматель;
- стать учредителем Общества с ограниченной ответственностью или, другими словами, ОАО.
Если вы все-таки остановились на первом варианте, то имейте в виду, что для организации аптечного дела директор учреждения должен иметь как минимум высшее образование фармацевта или, в крайнем случае, фармацевта, установленного Федеральным Закон. Закон № 61 «Об обращении лекарственных средств».
Если вы учредили акционерное общество, то можно обойтись и без специального образования.
Прибыльное дело
Если серьезно заняться всеми сопутствующими вопросами, аптечный бизнес можно открыть за 10 месяцев. В крупных городах такие сети открываются очень часто. Следовательно, можно сделать вывод, что прибыль аптеки превышает все расходы, необходимые для ее открытия.
Это и понятно, если в крупном городе население более 4 000 000 человек, то велика вероятность эпидемий и других заболеваний, что естественно увеличивает продажи и прибыль аптек.
Что именно нужно для открытия собственной аптеки, мы напишем ниже.
Типы аптек
Что касается аптек, то они делятся на несколько видов:
- производство, которое занимается именно приготовлением лекарств;
- производства, но имеющих разрешение на изготовление антисептических препаратов;
- аптека, торгующая готовыми лекарствами;
- аптека.
Функции
Отраслевой стандарт описывает характеристики, которыми наделен каждый тип аптеки. Именно на их основе происходит раздача в аптеку, аптечный киоск и аптеку. Самый большой перечень функций возложен на аптеку.
Что касается должности аптеки, то ее функции несколько ограничены, например, она не имеет права продавать лекарства по рецептам, в отличие от аптеки.
Разумнее всего начать с открытия собственной аптеки, а уже потом думать о филиалах (киосках, точках). Совершенно нерационально просто так заводить маленькие аптечные киоски.
Совершенно нерационально просто так заводить маленькие аптечные киоски.
Стандарт в помощь
Если опустить оформление всей документации, самым важным моментом остается правильная подготовка помещения. Чтобы ничего не упустить и построить хороший аптечный бизнес, используйте отраслевой стандарт. В нем содержится подробный перечень всего, что должно быть в помещении аптеки.
Подойдите к этому вопросу рационально и при выборе ориентируйтесь на тип аптеки, которую собираетесь открыть. Если вы собираетесь открыть крупную аптеку с широким ассортиментом товаров, это подразумевает, что здесь потребуются регулярные консультации специалистов, ведь такая аптека должна обслуживать покупателей на самом высоком уровне. Поэтому лучше обратить внимание на помещения в центре города, в тех местах, где проходит большое количество посетителей.
Аптека, в которой есть все
Основа крупной аптеки подразумевает наличие в ней самых дорогих и редких лекарств. Любой посетитель, зашедший в эту аптеку, должен знать, что здесь можно купить все необходимые лекарства. Поэтому учредитель должен понимать, что такая масштабная аптека потребует огромных капитальных вложений. Вот и ответ на вопрос: «Сколько стоит открыть аптеку?». Это будет напрямую зависеть от того, какой тип аптеки вы хотите открыть.
Поэтому учредитель должен понимать, что такая масштабная аптека потребует огромных капитальных вложений. Вот и ответ на вопрос: «Сколько стоит открыть аптеку?». Это будет напрямую зависеть от того, какой тип аптеки вы хотите открыть.
Еще один недорогой вариант под названием «скидка» можно увидеть в такой сфере, как аптечный бизнес. Магазины со скидкой хороши только своими ценами, но сервис и скудный выбор лекарств многих расстраивают. Помещение для такой аптеки лучше поискать в одном из общежитий или возле станции метро. Эти аптеки часто посещают пожилые люди и другие семьи со средним достатком.
Требования
Помещение, подходящее для аптеки, должно иметь определенные параметры. Желательно, чтобы она не превышала 80 м2 и в ней должны быть следующие помещения:
- несколько рабочих помещений для распаковки, хранения и выдачи лекарств;
- кабинет для бухгалтера и заведующего аптекой, чтобы они могли хорошо выполнять свою работу;
- комната отдыха для сотрудников аптеки;
- гардеробная со шкафами для личных вещей персонала;
- файловая комната для хранения документов.

Важно!
Не пренебрегайте гигиеной и дезинфекцией помещения. Поэтому для отделки интерьера используйте только те стройматериалы, которые без проблем можно очистить тряпкой, смоченной в специальных дезинфицирующих средствах.
Позаботьтесь о достаточном дренаже и вентиляции. Важно, чтобы в аптеке было электричество, вода и тепло.
В каждом помещении, где хранятся лекарства, должны быть приборы, фиксирующие температуру и влажность воздуха. Это очень важно для правильного хранения лекарств.
Не забудьте купить специальные полки, стеллажи и шкафы для хранения ядовитых или наркотических препаратов, которые иногда назначают врачи.
Еще одним отдельным пунктом расточительства можно назвать покупку большого количества холодильников.
Безопасность
Теперь вы понимаете, что ваш аптечный бизнес не такой легкий и простой, как кажется на первый взгляд. Стоит только что-то забыть или запутаться, и сразу работа сорвется или дорогие лекарства испортятся.
Ответственный владелец перед открытием собственной аптеки позаботится о наличии в помещении пожарной и охранной сигнализации. Для его установки необходимо выделить отдельное помещение и зарегистрировать оборудование в Минздраве по всем правилам.
В ногу с прогрессом
С каждым годом прогресс идет вперед и люди уже не представляют свою жизнь без телефонов. Поэтому было бы очень неплохо организовать в своей аптеке такую услугу, как мобильная аптека. Такая услуга привлечет еще больше клиентов, и конечно же это скажется на прибыли.
Воспользовавшись данной услугой, клиенты смогут заказать любое лекарство по телефону с доставкой на дом, также возможна аналогичная продажа через интернет.
Лицо, принимающее заказ, должно быть квалифицированным фармацевтом, чтобы оказывать помощь путем консультирования клиентов.
Разрешения и документы для основания аптеки
После завершения ремонта и установки необходимого оборудования документы на получение лицензии на деятельность аптеки передаются в соответствующие органы.
После получения документов комиссия должна лично явиться в аптеку с проверкой до выдачи лицензии. Они должны проверить как помещение, так и оборудование. Иногда эти проверки могут длиться несколько месяцев. После получения положительного отзыва владелец аптеки может рассчитывать на получение лицензии на пять лет.
До получения лицензии купить товар невозможно. Начав оптовую закупку лекарств, вы официально начинаете свой фармацевтический бизнес.
Сколько стоит открыть аптеку
Ответ вы получите, когда подсчитаете деньги, потраченные на ремонт, покупку или аренду помещения и вложения в покупку необходимых лекарств и сопутствующих товаров гигиены.
За начальный этап до открытия аптеки придется заплатить не менее 100 000 условных единиц. Ассортимент обязательно должен состоять не менее чем из 4000 различных видов продукции. Сумма, затраченная на приобретение фармацевтической продукции, должна составлять не менее 40 тысяч условных единиц.
Ассортимент
Если аптека будет находиться в новом районе, убедитесь, что ассортимент лекарств такой же, как и в ближайшей аптеке, а возможно, и лучше. Естественно, база продаж (третья часть) — это список самых распространенных лекарств от простуды, болей в сердце, успокоительных средств и средств гигиены. Если все эти позиции присутствуют в ассортименте вашей аптеки, почти все посетители останутся довольны.
Естественно, база продаж (третья часть) — это список самых распространенных лекарств от простуды, болей в сердце, успокоительных средств и средств гигиены. Если все эти позиции присутствуют в ассортименте вашей аптеки, почти все посетители останутся довольны.
Старайтесь не переборщить с наценкой, она не должна быть больше 20% от стоимости покупки. Если цены слишком высоки, клиенты будут постепенно уходить от вашего заведения к конкурентам, которые не такие жадные.
При формировании ассортимента используйте информационные системы различного типа. Они значительно упростят заказ любых лекарств, учитывая оптовые цены и удобные способы доставки.
Своими системами пользуются крупные аптеки, также в их арсенале есть личный автотранспорт, который перевозит лекарства, снижая их цену. Что касается небольших аптек, то они используют такой метод, как «прейскурант».
Пакет документов и режим работы
Согласно положению о лицензировании фармацевтической деятельности и создании аптеки, вам необходимо собрать большое количество разрешительных документов и документов.
Работа аптеки может осуществляться двумя способами по выбору владельца:
- в закрытом виде, когда препараты находятся за прилавком аптеки и доставляются лично продавцом;
- в открытом виде, когда все товары аптеки расставлены в торговом зале и на дополнительных полках, с которых покупатель может взять все необходимое.
Открытие аптеки второго режима целесообразно только в том случае, если это крупный город, и он может принимать посетителей от 10 000 человек. Продажа продукции в такой аптеке обычно выше, чем в других аптеках не менее чем на 25%.
Взыскания к персоналу учреждения
В то время, когда развитие аптечной сети пошло в гору, необходимо задуматься о санкциях для сотрудников. Такие штрафы должны быть отражены в отраслевом стандарте.
Требования к владельцу аптеки и персоналу
Заведующий аптекой должен иметь:
- диплом с указанием высшего медицинского образования по специальности фармацевт или провизор;
- опыт работы в области медицины должен быть не менее трех лет, желателен профессиональный сертификат.

Если заведующий аптекой является частным предпринимателем, то от него также требуется наличие диплома о высшем медицинском образовании и стажа работы по специальности более трех лет, либо если предприниматель является провизором, то стаж должен быть не менее пять лет.
Весь персонал аптеки должен соответствовать требованиям управляющего, соблюдать все правила при работе с лекарствами, каждые пять лет проходить обучение.
Сопутствующие товары
Сегодня ассортимент товаров, реализуемых в аптеках, стал более разнообразным. Теперь на полках аптек есть не только лекарства и другие медицинские товары. Владелец имеет право расширить ассортимент за счет сопутствующих товаров в аптеке.
В принципе, сегодня все современные аптеки расширяют свой ассортимент за счет не только средств гигиены и косметики, но и других сопутствующих товаров (чаще всего это товары для детей).
В прошлом в каждом городе была аптека для матери и ребенка, где помимо обычных лекарств можно было приобрести различные товары для ухода за ребенком. Это специальное детское питание, аксессуары для новорожденных, различные добавки и травы. Сегодня все эти товары можно купить не только в детском магазине, но и в каждой аптеке.
Это специальное детское питание, аксессуары для новорожденных, различные добавки и травы. Сегодня все эти товары можно купить не только в детском магазине, но и в каждой аптеке.
Регистрация лекарственных средств в России
Обзор регистрации лекарственных средств в России
Ожидается, что объем российской фармацевтической отрасли в 2020 году превысит два триллиона российских рублей, что примерно на 10 % больше, чем в предыдущем году. Ожидается, что к 2023 году фармацевтическая выручка достигнет 2,35 трлн российских рублей. Стоит также отметить, что сроки получения разрешений являются одними из самых быстрых в мире (Statista). Однако имейте в виду, что российское фармацевтическое законодательство не всегда соответствует международным стандартам. Это первый из двух блогов о регистрации лекарственных средств в России, посвященный:
- Регулирующие органы
- Надлежащая производственная практика в России
- Доклинические исследования
- Проведение локальных клинических исследований в России
- Клинические исследования Применение в России
Предыдущее законодательство о медицинском распространении было обязательным товары, принятые в 2010 году. Однако с конца 2020 года национальный процесс авторизации больше не будет действовать. Как следствие, существует мало законодательных и нормативных положений. Кроме того, регулирующие правила в фармацевтической промышленности часто дублируют законодательные законы, но не развивают их. Таким образом, такие нормативные оговорки можно считать излишними. Опять же, фармацевтическое законодательство отличается от других видов законодательства о продуктах медицинского назначения, таких как правила медицинского оборудования или косметики. Многие спорные элементы включены в закон. Однако они не применяются и не соблюдаются. Например, не соблюдаются юридические определения исследований биоэквивалентности или дженериков, а человеческие и ветеринарные требования объединены в одном законодательстве.
Однако с конца 2020 года национальный процесс авторизации больше не будет действовать. Как следствие, существует мало законодательных и нормативных положений. Кроме того, регулирующие правила в фармацевтической промышленности часто дублируют законодательные законы, но не развивают их. Таким образом, такие нормативные оговорки можно считать излишними. Опять же, фармацевтическое законодательство отличается от других видов законодательства о продуктах медицинского назначения, таких как правила медицинского оборудования или косметики. Многие спорные элементы включены в закон. Однако они не применяются и не соблюдаются. Например, не соблюдаются юридические определения исследований биоэквивалентности или дженериков, а человеческие и ветеринарные требования объединены в одном законодательстве.
Кто является органом, отвечающим за регистрационное удостоверение
По сравнению с другими странами и регионами российская нормативно-правовая база в отношении товаров медицинского назначения достаточно фрагментирована. Регистрацией лекарственных средств в России занимаются как минимум четыре отдельных компетентных органа.
Регистрацией лекарственных средств в России занимаются как минимум четыре отдельных компетентных органа.
Минздрав России
Минздрав России отвечает за выдачу регистрационного удостоверения, подачу заявок на клинические исследования и контроль цен на отдельные лекарственные средства, включенные в Российский перечень основных лекарственных средств. Кроме того, в Министерстве здравоохранения есть специальное государственное учреждение; ФГБУ. Это учреждение оценивает досье заявки на получение торговой лицензии и другие типы досье, такие как досье заявки на клиническое испытание, досье изменения или обновления.
Минпромторг России
Вторым государственным органом, важным для регулирования лекарственных средств для человека, является Минпромторг. Это учреждение отвечает за выдачу разрешений производителей для местных предприятий и сертификацию GMP производственных мощностей в России и за рубежом.
Росздравнадзор
Следующим важным игроком в сфере регулирования является Росздравнадзор, российская аббревиатура Федерального агентства по надзору в сфере здравоохранения и социального развития. Это заведение:
Это заведение:
- за рубежным фармаконадзором человеческих фармацевтических препаратов
- Проводит инспекции GCP
- Проводящие проверки GLP (ограниченные лекарствами человека)
- отвечает за официальное испытание на высвобождение партии
Надлежащая производственная практика в России
Аккредитация GMP является серьезной проблемой для иностранных фармацевтических компаний. Чтобы подать заявку на получение регистрационного удостоверения в России, вы должны иметь действующий сертификат надлежащей производственной практики (GMP) в Российской Федерации; зарубежные сертификаты GMP не признаются.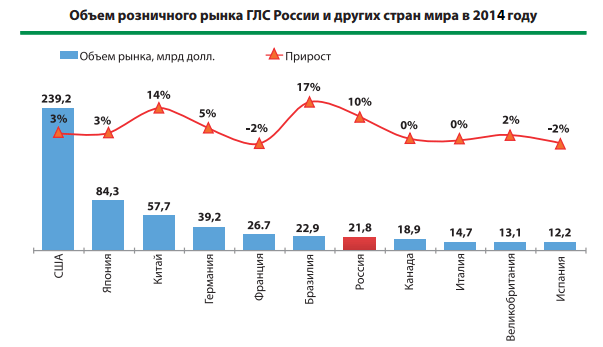 Не имеет значения, находится ли производитель в государстве-члене ICH или PIC/S.
Не имеет значения, находится ли производитель в государстве-члене ICH или PIC/S.
Однако в качестве подтверждения соответствия российским требованиям GMP принимается сертификат GMP, выданный государством-членом Евразийского экономического союза (ЕАЭС) (Беларусь, Казахстан, Армения или Кыргызстан). Инспекция GMP находится в Министерстве промышленности и торговли; это отдельная государственная организация, известная как Федеральное бюджетное учреждение, отвечающее за Государственный институт лекарственных средств и надлежащей практики.
Процесс подачи заявки на инспекцию не связан с выдачей разрешения на продажу. Если сертификат GMP, выданный Министерством промышленности и торговли, не существует, заявление на получение маркетинговой лицензии все же может быть подано, если предприятие предоставит подтверждение от Фармацевтической инспекции о том, что проверка будет проводиться в будущем. В этой ситуации регистрационное удостоверение будет отложено до тех пор, пока вы не предоставите действующий сертификат GMP после оценки Российской инспекцией GMP.
Какова GMP России по сравнению с ЕС?
Приказ GMP для России основан на правилах Надлежащей производственной практики Европейского Союза, которые содержатся в EudraLex – Том 4. В частности, были переведены Глоссарий, части I–III и приложения к части I. Однако были внесены различные коррективы, в результате чего между российскими нормами и нормами ЕС возникли небольшие расхождения.
Следует отметить, что при разработке русскоязычной версии GMP правительство уделяло первостепенное внимание техническим компонентам надлежащей производственной практики, в основном игнорируя процедурные. Это привело к процессуальной двусмысленности, которую необходимо исправить.
Например, в Приказе GMP отсутствуют положения, аналогичные положениям, включенным в Разделы IV и XI Директивы 2001/83/ЕС, Директиве Европейского Союза 1572/2017, а также национальные требования государств-членов ЕС, такие как те, которые содержатся в Положение о лекарственных средствах для человека 2012 г.
Сроки получения российского сертификата GMP
В связи с тем, что законы GMP вступили в силу относительно недавно, количество заявок на получение сертификатов GMP превысило оперативные возможности Инспекции, в результате чего сформировался лист ожидания с огромным период ожидания от шести до двенадцати месяцев.
В связи с этим крайне важно изучить сертификацию GMP заблаговременно до подачи заявки на получение разрешения на продажу. Кроме того, сертификаты необходимо продлевать не реже одного раза в три года, а также требуются проверки для продления. Тем не менее, объем проверки может быть установлен риск-ориентированным подходом.
Министерство здравоохранения отклонит заявку на получение разрешения на продажу, если соответствующие производственные мощности не были проверены на соответствие GMP. Прежде чем запрашивать маркетинговую лицензию, заявитель должен согласовать и утвердить дату проверки с Министерством промышленности и торговли и Инспекцией GMP.
Иногда иностранные производители готовой продукции могут столкнуться с трудностями при проверке конкретного продукта, так как основной документ контроля качества в России является нормативным документом, который часто отличается от спецификации производителя.
Нормативный документ в России
Основанием для нормативного документа является Российская государственная фармакопея, не гармонизированная с другими фармакопеями; также оценщики часто дают рекомендации по улучшению аналитических процедур нормативного документа. Эти предложения, однако, основаны на результатах тестирования, полученных в официальной лаборатории, которая не проводит валидацию или передачу метода при проверке процедур тестирования заявителя. Наши специалисты с удовольствием обсудят с вами действенный способ облегчить эту процедуру, помогут минимизировать риски и преодолеть препятствия, связанные с получением свидетельства о регистрации лекарственных средств в России.
Доклинические исследования для регистрации лекарственных средств в России
Данные доклинических исследований могут потребоваться в некоторых ситуациях при подаче заявки на клиническое исследование, при подаче заявки на получение регистрационного удостоверения или при продлении/продлении срока действия медицинского изделия. Тем не менее, есть несколько уникальных трудностей. Во-первых, федеральные правила требуют, чтобы все неклинические эксперименты проводились в соответствии с GLP.
Тем не менее, есть несколько уникальных трудностей. Во-первых, федеральные правила требуют, чтобы все неклинические эксперименты проводились в соответствии с GLP.
Таким образом, неклинические исследования PD и PK также должны соответствовать стандартам GLP; это обычно неосуществимо. Однако, поскольку это соответствие обычно не контролируется регулирующим органом, до сих пор не возникло никаких трудностей в связи с этой проблемой. Тем не менее, имейте в виду, что вы должны адекватно объяснить это регулирующим органам или оценщикам в случае наблюдений. Необходимо отметить, что в России действуют две системы GLP, которые не согласуются друг с другом:
- Общие законы GLP, которые соответствуют рекомендациям GLP ОЭСР
- Во-вторых, существует Приказ GLP для конкретных фармацевтических препаратов, который представляет собой значительно сокращенную версию стандартов GLP ОЭСР.
Поскольку рекомендации OECD GLP охватывают российские правила GLP, относящиеся к фармацевтическим препаратам, в этой области не должно возникнуть проблем, если заявитель следует рекомендациям OECD GLP при проведении доклинических исследований.
Следующая возможная проблема связана с необходимостью для общих или гибридных приложений предоставлять данные неклинических испытаний. (В некоторых случаях гибридные приложения называются IMD или поэтапно модифицированными лекарствами.) Хотя эта потребность устарела и в некоторых случаях может быть заменена подробными библиографическими данными, аналогичные наблюдения продолжают появляться и могут быть рассмотрены с помощью подробных объяснений и библиографических данных. . Обычно требуется две-четыре недели испытаний на подострую токсичность и местную переносимость. Естественно, предпочтительнее решить эти проблемы и изучить ваши варианты продолжения лечения без дополнительного тестирования in vivo.
Местные клинические испытания
Российские нормативные акты требуют, чтобы как минимум одно клиническое исследование было проведено в российских клинических учреждениях. Однако в многоцентровых исследованиях может быть добавлен один российский центр в соответствии с местными требованиями к клиническим испытаниям.
Положение прямо исключает возможность тиражирования или реализации полной программы клинических исследований в России. Кроме того, нет обязательства проводить всю фазу (т. е. многочисленные КИ) программы клинической разработки. Наконец, клинические испытания считаются исследованиями биоэквивалентности. В связи с тем, что исследование биоэквивалентности редко бывает целесообразным разделить на несколько клинических центров, полное исследование должно быть проведено или повторено в России для дженериков. В других обстоятельствах наиболее целесообразной альтернативой является международное многоцентровое клиническое исследование.
В то же время не допускаются исследования ранней фазы (фаза 1) на здоровых участниках с использованием материалов для клинических исследований, произведенных за рубежом. Эти положения защищают здоровых людей от испытаний ранее не испытанных химических веществ на здоровых российских людях. Однако такие исследования допустимы, когда в них участвуют пациенты. Таким образом, если желательно провести исследование фазы 1 на здоровых добровольцах, предпочтительнее найти российского партнера, способного выполнить хотя бы один этап производства (например, упаковку).
Таким образом, если желательно провести исследование фазы 1 на здоровых добровольцах, предпочтительнее найти российского партнера, способного выполнить хотя бы один этап производства (например, упаковку).
Клинические исследования должны проводиться в соответствии с Российским приказом GCP, который основан на ICH GCP(R1), но является менее строгим. Однако, несмотря на то, что соблюдение GCP не имеет решающего значения для Министерства здравоохранения и экспертов, простой декларации о соответствии может быть достаточно.
Когда в России нет необходимости в клинических исследованиях?
Заявители освобождаются от обмена данными местных клинических испытаний в ряде случаев. Таковы обстоятельства, предусмотренные статьей 18 Федерального закона.
Если вы проводили исследование в Беларуси Интересно, что связь между Россией и Беларусью заметна в регистрации лекарств в России. Если клиническое исследование проводилось в Беларуси, такое исследование считается локальным клиническим исследованием, поскольку Россия имеет тесную связь с этой республикой.
Кроме того, некоторые дженерики освобождены от требования предоставления данных клинических испытаний, чтобы соответствовать определенным критериям биовейвера, будь то местные или национальные. Например, пероральные или парентеральные растворы или медицинские газы могут быть разрешены только после получения данных о фармацевтической эквивалентности. Дополнительные сильные стороны также могут быть одобрены без клинических данных, хотя такой вид биовейвера не разрешен федеральными стандартами. Поскольку в регламенте нет формальных критериев биовейвера повышенной прочности, эксперты должны определять применимость этого вида биовейвера на индивидуальной основе.
Орфанные препаратыВо-первых, орфанные лекарственные средства освобождаются от локальных клинических исследований, поэтому локальные клинические данные не требуются, если лекарственный препарат признан в России орфанным.
Комбинированные продукты Для некоторых комбинированных продуктов дополнительные клинические данные не требуются, как это предусмотрено законодательством. В этих случаях библиографических данных может быть достаточно. Местные клинические испытания также не нужны, если для зарегистрированного лекарственного средства добавляются новые способы применения или показания.
В этих случаях библиографических данных может быть достаточно. Местные клинические испытания также не нужны, если для зарегистрированного лекарственного средства добавляются новые способы применения или показания.
Заявка на клиническое исследование для регистрации лекарственного средства в России
Продолжительность процедуры СТА составляет всего 30 рабочих дней, а требования к заявкам на клинические исследования достаточно свободны. Например, не требуется досье на исследуемый лекарственный препарат. вам нужно только предоставить клинические документы, касающиеся досье заявки на клиническое исследование, такие как:
- Протокол исследования
- Брошюра исследователя
- Форма информированного согласия
- Форма отчета о болезни
- Страховой полис
- И т. д.
Наличие сертификата соответствия качества исследуемого продукта достаточно в досье СТА. Досье на исследуемые лекарственные препараты или другие документы, достаточно подробно описывающие аспекты качества исследуемого препарата, не требуются. Как правило, научные стандарты планирования и проведения клинических исследований соответствуют международно признанным подходам, изложенным в руководствах и методических документах ICH, EMA, ВОЗ или FDA.
Как правило, научные стандарты планирования и проведения клинических исследований соответствуют международно признанным подходам, изложенным в руководствах и методических документах ICH, EMA, ВОЗ или FDA.
В ходе процедуры заявителю может быть направлен как минимум один запрос на дополнительную информацию и/или данные, на который необходимо ответить в течение максимум 90 рабочих дней. Если вы этого не сделаете, Министерство здравоохранения завершит процесс на основании первоначально поданных вами данных заявки.
Дальнейшие шаги по регистрации лекарств в России
После ваших усилий по регистрации лекарств в России власти оценивают качество, эффективность и безопасность вашего продукта, чтобы получить разрешение на его медицинское использование в Российской Федерации. Узнайте о следующих шагах процесса во второй части этой серии и узнайте, как получить регистрационное удостоверение в России.
Чтобы помочь вам подготовить и обосновать применимость исключений и отказов, мы будем рады воспользоваться нашим опытом. Это может сэкономить вам дорогостоящие усилия.
Это может сэкономить вам дорогостоящие усилия.
Начните разговор с одним из наших экспертов здесь.
Требования к регистрации лекарственных средств для различных стран
Перед экспортом фармацевтического продукта в Россию он должен пройти регистрацию в Минздраве РФ. По сути, это отдел регистрации лекарственных средств. Федеральной службы по надзору в сфере здравоохранения (109074 Москва, Слав. пл. 4, стр.1; Тел.: +7 095 298 4628; +7 095 925 6661, +7 095 298 3496, +7 095 298 3534, +7 095 298 5342), который отвечает за процедура регистрации. В России до сих пор есть свои, уникальные нормативные система, которая не соответствует практике США или ЕС.
Не только культурные и языковые барьеры часто становятся проблемой
иностранным компаниям, пытающимся зарегистрировать фармацевтические препараты самостоятельно;
это также процедура регистрации, которая довольно сложна
и документы, как правило, модифицируются из-за постоянных изменений в
нормативные требования. Таким образом, лучший способ выполнить регистрацию
фармацевтического продукта в России через один из следующих
типы компаний:
Таким образом, лучший способ выполнить регистрацию
фармацевтического продукта в России через один из следующих
типы компаний:
— компания, зарегистрированная в России и принадлежащая индийской материнской компании
компания,
— консалтинговая компания.
Для процедуры регистрации компания должна представить следующие документы:
1. Общие документы:
* Заявление о государственной регистрации лекарственного средства,
включает название фармацевтического препарата, наименование и
контактная информация производителя
* Название фармацевтического препарата, в том числе международное
непатентованное название, научное название на латинице, торговое название и основная
синонимы
* Рекомендуемая дозировка, инструкция по применению
* Описание препарата и его упаковки, срок годности и условия хранения условия
* Доверенность, выданная производителем на уполномоченное компания для проведения регистрационной процедуры (нотариально заверенный оригинал с апостилем)
2. Сертификаты:
Сертификаты:
* Копия сертификата свободной продажи (должна быть нотариально заверена и апостилирована)
* Копия сертификата GMP (должна быть нотариально заверена и апостилирована)
* Копия Свидетельства о регистрации производителя в собственном страна (должно быть нотариально заверено и апостилировано)
* Оригинал Сертификата анализа препарата и его действующего вещества субстанция (должна быть подписана и проштампована производителем)
* Копия Свидетельства на товарный знак (должна быть подписана и скреплена печатью) производителем)
3. Информация и протоколы испытаний:
* Краткая информация о способе изготовления ЛС (должна быть подписана
и штамп производителя)
* Полное описание количественного и качественного контроля
методы со ссылками на фармакопею и спецификацию (обязательно
с подписью и печатью производителя)
* Данные о стабильности трех серий препаратов – на дату
* Картины спектров и хроматограмм препарата
* Отчет об испытаниях токсичности препарата (острая, подострая, субхроническая, хроническая токсичность)
* Отчет об испытаниях специфических воздействий (канцерогенность, мутагенность и тератогенное действие, эмбриотоксичность, аллергические и местно-раздражающие эффекты)
* Отчет о клиническом испытании применения препарата в клинике (информация что касается только того препарата, который выпускается данным производителем)
* Копии публикаций о применении препарата в клиниках после его регистрации в стране происхождения (информация, которая касается только того препарата, который выпускается данным производителем)
* Сводная информация о побочных эффектах в сравнении с другими аналогичные лекарственные средства, применяемые по тем же показаниям
* Инструкция по применению (должна быть подписана и скреплена печатью производителя)
4. Образцы и упаковка:
Образцы и упаковка:
* Цветовое оформление внутренней и внешней упаковки (оригинал и рус. версия)
* Стандартные образцы действующего вещества для контроля качества
* Стандартные и эталонные образцы препарата для обязательной экспертизы качества (должен быть в стандартной упаковке)
К документам, необходимым для регистрации, относится свидетельство
анализа препарата в стране происхождения производителя,
Сертификат GMP и информация о регистрации препарата в
иностранное государство. Министерство здравоохранения определяет, являются ли эти
разрешений достаточно для освобождения препарата от клинического применения.
и другие испытания в России перед выдачей регистрационного удостоверения.
В соответствии с Законом о лекарственных средствах сбор в виде государственной пошлины за государственную регистрацию взимается плата, а регистрация должна принимать не более полугода. На самом деле эта плата не была официально установленный Правительством Российской Федерации до сейчас. Вместо этого орган экспертизы, назначенный для обязательного рассмотрения Минздрав ввел значительные сборы ($12.000 за каждую позицию для иностранных производителей) за «экспертиза». Что касается процесса регистрации, то он часто занимает больше времени, чем шесть месяцев.
Для получения дополнительной информации о регистрации также см.
на следующем сайте: www.pharminform.ru. Он принадлежит
Российская консалтинговая компания «Фарминформ» предлагает информацию в
Английский.
На самом деле каждая компания, которая хочет экспортировать продукцию в Россию, рекомендуем работать с надежными партнерами и консалтинговыми компаниями по вопросам регистрации лекарственных средств. Пожалуйста, ожидайте «препятствий» и методы ведения бизнеса, которые могут быть не распространены в вашей стране. Но наличие русскоязычного партнера определенно сделает вас жить намного проще!
Обратите внимание, что все товары (косметика, витамины, товары для здоровья) продукты, натуральные продукты и т.д.) можно вывозить только в Россию после их регистрации.
Примечание MSI:
Многие экспоненты спрашивают нас, есть ли смысл посещать выставку «Аптека».
без регистрации своей продукции в России. Насколько далеко
как мы можем сказать из 12-летнего опыта работы с фармацевтической
бизнеса на рынках СНГ, мы можем порекомендовать представить свои
продукты на нашей выставке еще до регистрации продукта.

 Данная инфраструктура выдает соответствующие разрешения на основании противопожарной безопасности объекта.
Данная инфраструктура выдает соответствующие разрешения на основании противопожарной безопасности объекта.
